La vanilline
Sujet avec uniquement la partie Spectroscopie IR – la numérotation est identique au sujet complet
Cliquez ici pour télécharger le sujet complet
ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH107 et n°SPEPHCH114
La vanilline est la substance aromatique que l’on trouve dans les gousses de vanille. Ce terme désigne aussi l’arôme de synthèse qui imite au plus près le goût de la vanille naturelle. C’est l’arôme le plus utilisé au monde dans des desserts et autres plats sucrés et en parfumerie.

Synthèse de la vanilline
La molécule de vanilline (4-hydroxy-3-méthoxybenzaldéhyde) est représentée ci- contre.
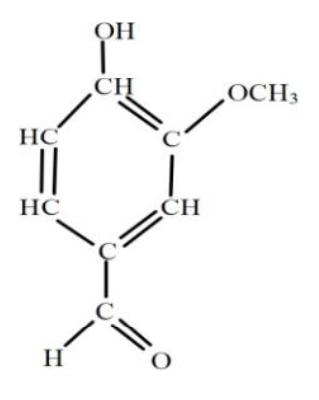
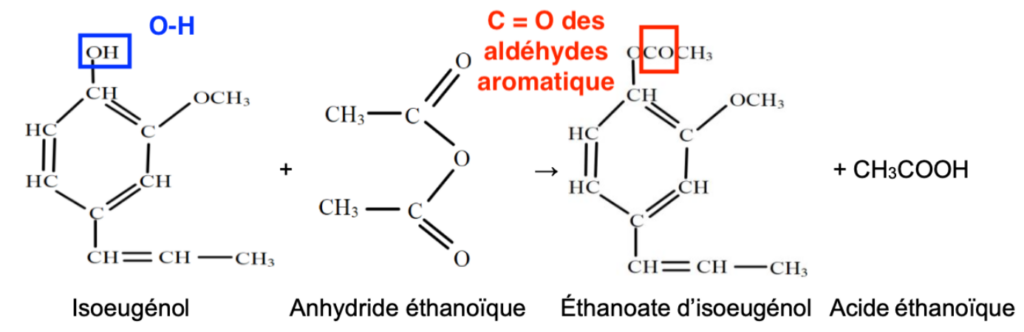
La synthèse de la vanilline se fait en plusieurs étapes. Nous allons étudier la première étape c’est-à-dire la synthèse de l’acétate d’isoeugénol à partir de l’isoeugénol.
Mode opératoire :
- Dans un ballon de 250 mL, introduire 10 g d’isoeugénol, 20 mL d’anhydride éthanoïque et quelques gouttes de catalyseur.
- Chauffer en utilisant un montage à reflux et maintenir une ébullition douce pendant 30 minutes.
- Refroidir jusqu’à température ambiante.
- Verser le contenu du ballon dans un bécher contenant 30 mL d’eau glacée, tout en agitant.
- Filtrer et laver les cristaux formés avec de l’eau glacée.
La transformation est totale et l’équation de la réaction modélisant cette transformation est la suivante :
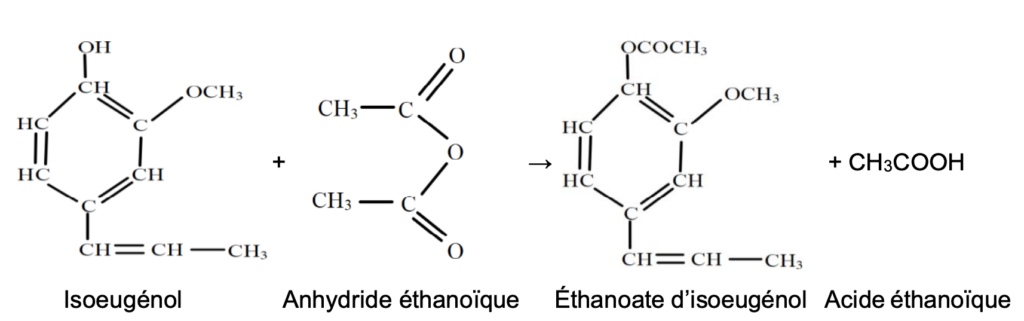
Données à 25 °C :
| Espèce chimique | Masse molaire moléculaire (g.mol-1) | Quelques propriétés |
| Isoeugénol | 164 | Densité d = 1,06 ; Nocif en cas d’ingestion et irritant pour les yeux, les voies respiratoires et la peau. |
| Éthanoate d’ isoeugénol | 205 | Température de Fusion Tfusion = 80 °C ; Soluble dans la plupart des solvants organiques et insoluble dans l’eau glacée |
| Anhydride éthanoïque | 102 | Densité d = 1,08 ; Corrosif, inflammable, provoque des brûlures. Peut réagir violemment avec l’eau. |
5. Reproduire la molécule de vanilline puis entourer et nommer les groupes caractéristiques.
Réponse : (cliquez pour faire apparaître)
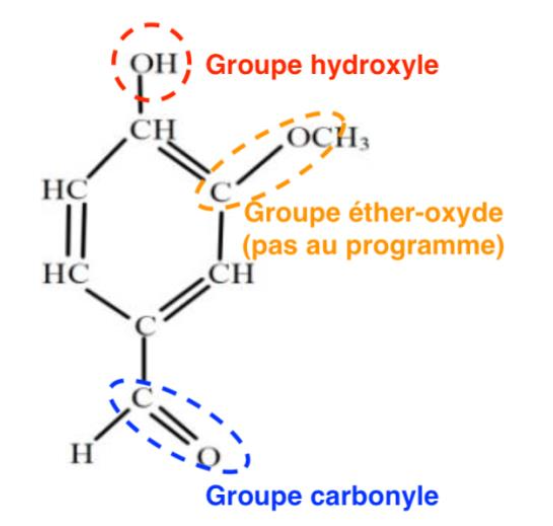
Les groupes caractéristiques de la molécule de vanilline sont :
- C—O—C : Groupe éther-oxyde (pas au programme)
- —OH : Groupe hydroxyle
- C=O : Groupe carbonyle
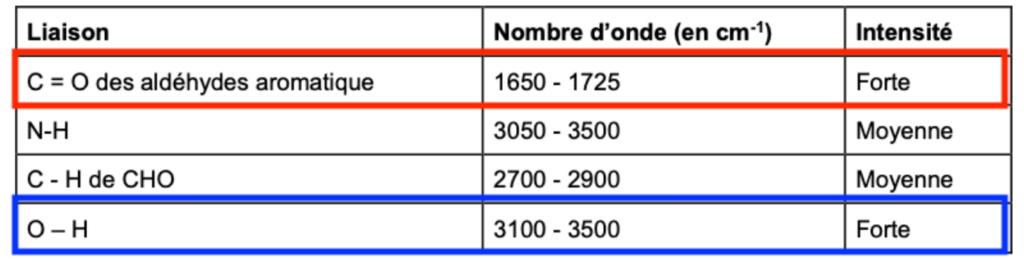
Données : Extrait de table de données
| Liaison | Nombre d’onde (en cm-1) | Intensité |
| C = O des aldéhydes aromatique | 1650 – 1725 | Forte |
| N-H | 3050 – 3500 | Moyenne |
| C – H de CHO | 2700 – 2900 | Moyenne |
| O – H | 3100 – 3500 | Forte |
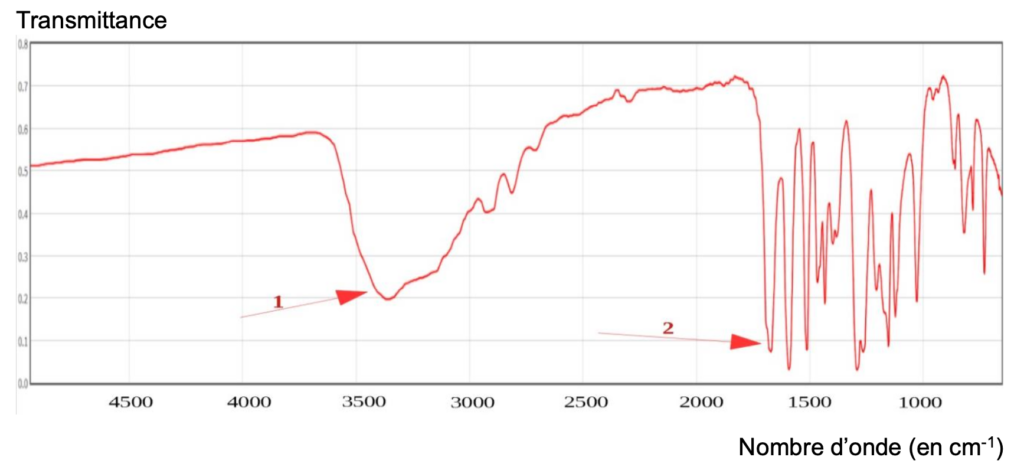
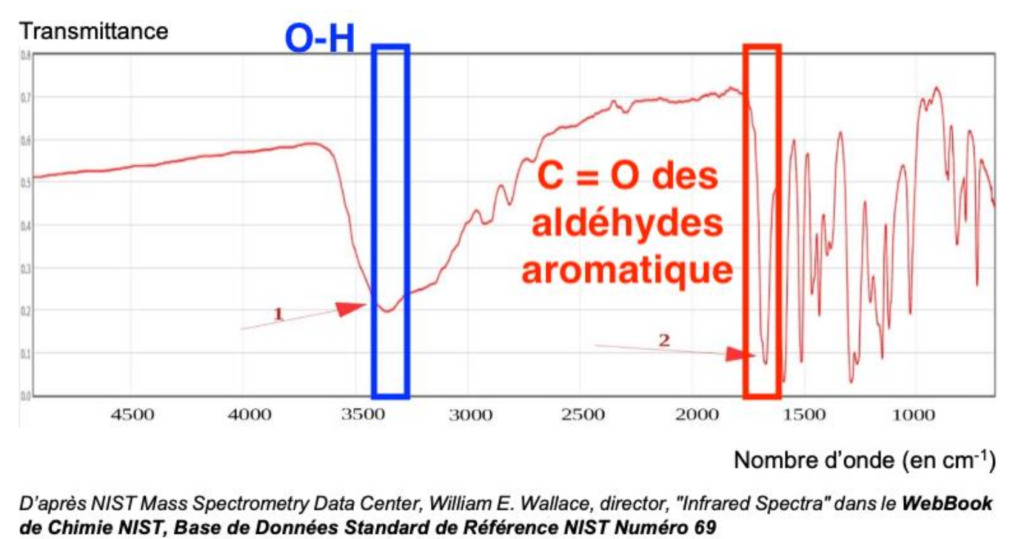
Pour analyser la molécule finale synthétisée au bout de toutes les étapes, l’expérimentateur réalise le spectre IR ci-dessous :
D’après NIST Mass Spectrometry Data Center, William E. Wallace, director, « Infrared Spectra » dans le WebBook de Chimie NIST, Base de Données Standard de Référence NIST Numéro 69
11. Identifier les groupes caractéristiques appartenant aux deux bandes d’absorption 1 et 2 et conclure quant à la synthèse de la molécule de vanilline.
Réponse : (cliquez pour faire apparaître)
D’après la table spectroscopique IR :
- Une bande 1 vers 3400 cm-1 est caractéristique de la liaison O-H (aucune molécule de la réaction n’a du N—H)
- Une bande vers 1700 cm-1 est caractéristique de la liaison C = O des aldéhydes aromatique
On en déduit que la synthèse de la molécule de vanilline a bien eu lieu (apparition de la bande caractéristique de la liaison C = O des aldéhydes aromatique absente des réactifs).
