Titrage
Un dosage par titrage direct consiste à faire réagir deux solutions dont une a une concentration connue et l’autre non. La réaction qui sert de dosage doit être totale, rapide et unique.
L’équivalence correspond au mélange stœchiométrique des réactifs pour la réaction mis en jeu. A l’équivalence, il y a changement du réactif limitant.
Exemple : Titrage des ions Fer(II) :
Prenons un volume V1 (mesuré précisément avec une pipette jaugée) de solution acidifiée de sulfate de Fer(II), à une concentration C1 inconnue.
On l’introduit dans un erlenmeyer avec un barreau aimanté placé sous un agitateur magnétique. Nous y versons à l’aide d’une burette graduée, une solution de permanganate de potassium de concentration C2 connue.
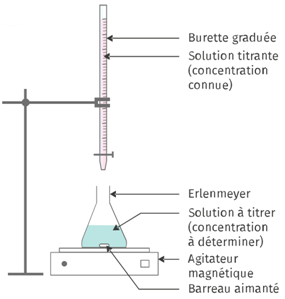
Comment repérer l’équivalence de ce dosage ?
Avant l’équivalence, chaque goutte de permanganate de potassium est consommée, la solution reste incolore. Cependant, une goutte après l’équivalence, la solution se teint légèrement en violet. On relève alors sur la burette graduée V2E (le volume versé a l’équivalence).
On atteint l’équivalence, lorsqu’on a réalisé un mélange stœchiométrique des deux réactifs qui sont alors totalement consommés.
Généralisation à tous les titrages
Soit le dosage de A par B selon l’équation : a A + b B → c C + d D
A l’équivalence :
![]()
Nous pouvons ainsi connaître la quantité de matière, la masse ou la concentration de l’espèce dosée.
